 Füzik |  Home | IX. Gazdünamik
|  | Porträ (bearbeitet) Fundctelle |
 Füzik |  Home | IX. Gazdünamik
|  | Porträ (bearbeitet) Fundctelle |
Misst man di Massen fon tsvei fercidenen idealen Gazen bei gleixen Tsuctandsbedingungen, alzo bei gleixem Drukk, gleixer Temperatur unt gleixem Volumen, zo ist das Ferhältnis beider Massen gleix dem Ferhältnis der xemic bectimmten Molekulargevixte. Daraus folgt, dass bei gleixen Tsuctandsbedingungen jede Gazmenge aus der gleixen Anzahl fon Molekülen becteht. Als Betsugspunkt für di Gleixung tsviccen Drukk, Temperatur unt Volumen (Kapitel VIII, Gl. (1)) vält man nun den normalen Atmosfärendrukk fon 101,3 KPa, di Temperatur 0 ℃ unt das zogenannte Molvolumen fon 22,4 Litern. Di zo bectimmte Gazmenge ist ein Mol, ire Masse entcprixxt irem Molekulargevixt inn Gramm. 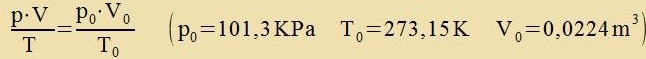 Hat man ctat eines Mols di Gazmenge m/M, zo kann dize Gleixung mit m/M multiplitsirt verden. Värend Drukk unt Temperatur ungeändert bleiben, ist das Volumen V dan das m/M-faxxe. 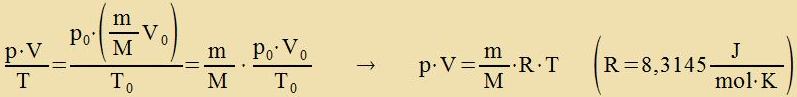 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dis ist di allgemeine Gazgleixung mit der Gazkonstanten R. Hält man eine der drei Tsuctandsgrösen fest, zo erhält man di drei con bekannten Cpetsialfälle. 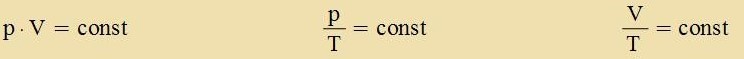 (bei konstanter Temperatur) (bei konstantem Volumen) (bei konstantem Drukk) Venn einer Gazmenge, di inn ein festes Volumen eingeclossen ist, Värmeenergi tsugefürt vird, dan vird nur die innere Energi der Gazmenge - das ist di mittlere Energi der ungeordneten Bevegungen unt Cwingungen der Moleküle - erhöht. Dize innere Energi U ist vi bei festen Ctoffen unt Flüssigkeiten inn begrentsten Temperaturbereichen proportional tsur Temperatur, der Proportsionalitätsfaktor ist di Värmekapatsität CV der Gazmenge. 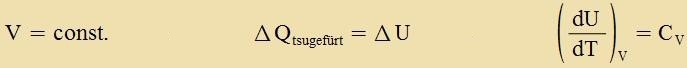 Di Värmekapatsität ist gröser, venn der Drukk konstant gehalten vird. Tsuzätslix tsur Temperaturerhöhung vird dan Arbeit geleistet, veil das Gaz zix gegen den äuseren Drukk ausdent. Vird dabei eine Fläxxe A gegen den Drukk p um di Ctrekke Δs zenkrext tsu A fercoben, dan ist di geleistete Arbeit ΔW =F∙Δs = p∙A∙Δs = p∙ΔV. 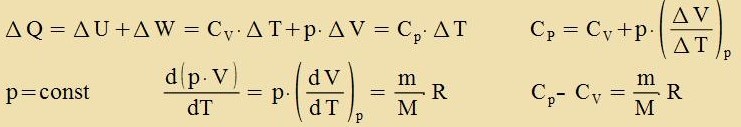 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Adiabatic vird eine Tsuctandsänderung genannt, venn tsviccen der Gazmenge unt irer Umgebung kein Energiaustauc statfindet. Jetst zint tsvar alle drei Tsuctandsgrösen Drukk, Volumen unt Temperatur variabel, aber dox durx di Bedingung ΔQ=0 unt di allgemeine Gazgleixung zo an einander gebunden, dass Feränderungen eindeutig ferlaufen. 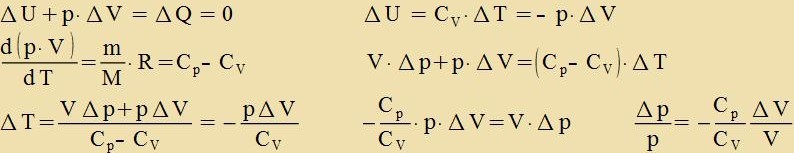 Der Grenzübergang ergibt eine Differentsialgleixung erster Ordnung mit dem Adiabatenkoeffitsienten κ = Cp/CV 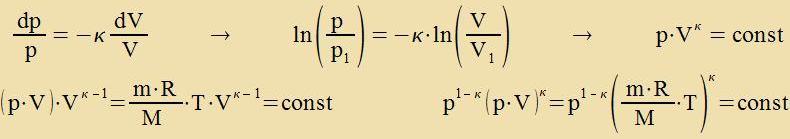 Es gelten di adiabaticen Tsuctandsgleixungen 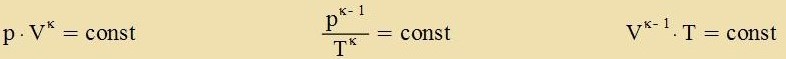
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Unter der fereinfaxxenden Anname, cV∙T zei di gezamte kinetice Energi der N Moleküle eines Mols, folgt für di mittlere kinetice Energi eines Moleküls
Di kinetice Energi der Translatsion eines Moleküls ist w=0,5∙m∙(vx2+vy2+vz2)=wx+wy+wz inn einem belibigen rextvinkligen Koordinatenzüstem. Das zint drei fon einander unaphengige Energiterme, alzo drei unaphengige Möglixkeiten, Energi inn Translatsionsbevegungen auftsunemen. Bei einem dreiatomigen Molekül gibt es tsuzätslix drei Möglixkeiten, Energi inn Rotatsionsbevegungen auftsunemen, värend bei einem tsveiatomigen Molekül di Rotatsion um di Ferbindungsakse beider Atome keine Energi aufnimt, veil das Trägheitsmoment um dize Akse tsu gering ist. Für eine ctatistic tsufällige Energiferteilung hat das einatomige Molekül 3 Freiheitsgrade, das tsveiatomige 5 unt das dreiatomige 6 Freiheitsgrade. Dize Freiheitsgrade f1=3, f2=5 unt f3=6 finden zix als Faktoren inn der letsten Tseile der Tabelle vider, di aus den Messergebnissen für κ entctand.
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Venn Kurven - Izoterme oder Adiabate - inn ein p-V-Diagramm getseixnet verden, ctellen di Fläxxen tsviccen der Kurve unt der V-Akse di beteiligten Energien dar. Pozitive Fläxxen, venn di Kurve fon links nax rexts durlaufen vird (Ekspanzion), bedeutet Arbeit, di fom Gaz geleistet vird. Bei Kompression, venn alzo eine Kurve fon rexts nax links durlaufen vird, ist di Fläxxe negativ, di Arbeit vird gegen das Gaz geleistet, di Energi inn das Gaz gectekkt. Bei einer Izotermen ist di Arbeit gleix der beteiligten Värme, da di innere Energi U nixt ferändert vird, bei einer Adiabaten ist di Arbeit gleix der Änderung der inneren Energi. Ein inn zix geclossener Kurventsug aus tsvei Adiabaten und tsvei Izotermen ctellt einen Carnotcen Kreizprotsesess dar, di imm Urtseigerzinn umclossene Fläxxe ist di insgezamt fom Gaz geleistete Arbeit Wgez.
Venn ein Värmerezervoar Rh der Temperatur Th ctändig di Värmeenergi Qh an den Kreizprotsess lifert unt auf der anderen Zeite ein Rezervoar Rk der Temperatur Tk di Apvärme Qk aufnimmt, vird fortlaufend ein bectimmter Teil der Värmeenergi inn Arbeit (mexanice Energi) umgezetst. Dis ist di Funktsion eines Värmekraftverkes unt dessen Virkungsgrad η ist definirt als der Anteil der eingezetsten Värmeenergi, der inn Arbeit umgezetst vird. Bei einem idealen Carnotcen Kreizprotsess ist (nur mit Beträgen gerexnet) 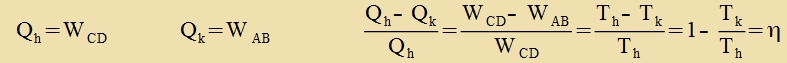
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dis ist eine fon mereren rext untercidlixxen Formulirungen des 2. Hauptzatses der Värmelere. Veil üblixxe Termometer di Messung der Temperatur auf di Messung der Ausdenung eines bectimmten Stoffes tsurükfüren (tsum Beicpil Kvekzilber) unt deshalb bei zer tifen Temperaturen unbrauxbar verden, veil di Ctoffeigencaften zix ändern, vird di Temperatur heute über den (idealen) Virkungsgrad des Carnotcen Kreizprotsesses definirt. Als Fikspunkt, der bei dizer Definitsion nötig ist, vurde der Tripelpunkt des Vassers gevält. Vird der Carnotce Kreizprotsess gegen den Urtseigerzinn durxlaufen, dan ändern zix di Fortseixen der Integrale. Es vird Arbeit inn Värme umgevandelt unt gleitseitig Värme fom küleren Rezervoar tsum värmeren transportirt (Külaggregat, Värmepumpe). Ein tsveifaxxes Durxlaufen inn untercidlixxer Rixtung ctellt den Ausgangstsuctand vider her, der Carnotce Kreizprotses ist reverzibel. Aux venn bei mermaligem Durxlaufen inn einer Rixtung di gevonnene Arbeit als mexanice Energi gecpeixert vird, um dan beim Durxlauf inn der anderen Rixtung eingezetst tsu verden, bleibt di Reverzibilität erhalten. Inn der Realität vird aber der ideale Vert nixt erreixt, es kann ni follctändig ferhindert verden, dass Värme ungenutst fom värmeren Rezervoar tsum kälteren übertrit oder irgendvo mexanice Energi 'dissipirt' (Reibungsferluste). Das ist kein Ferlust fon Energi, aber ein Ferlust fon 'brauxbarer' Värmeenergi.
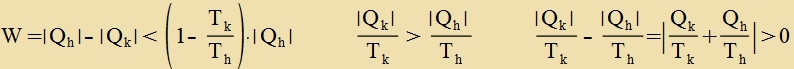
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Gazdünamik var di Grundlage dizes Kapitels. Di Ergebnisse nax Gleixung (15) zint allgemeinerer Art. Zo bedeutet der ctändige Temperaturausgleix tsviccen allen Körpern eine dauernde Apname der Helmholtzcen freien Energi unt Tsuname der Entropi. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||